Materi
KELIMPAHAN UNSUR DI ALAM
A. PENDAHULUAN Pada pelajaran bab ini akan dipelajari tentang kelimpahan unsurunsur di alam, sifat-sifat unsur-unsur halogen, gas mulia alkali, alkali tanah, unsur-unsur periode ketiga dan unsur-unsur transisi periode keempat, pembuatan dan kegunaan unsur-unsur halogen gas mulia, alkali tanah, unsurunsur periode ketiga dan unsur transisi periode keempat, dan menentukan kadar zat dalam senyawa.
Pada pelajaran bab ini akan dipelajari tentang kelimpahan unsurunsur di alam, sifat-sifat unsur-unsur halogen, gas mulia alkali, alkali tanah, unsur-unsur periode ketiga dan unsur-unsur transisi periode keempat, pembuatan dan kegunaan unsur-unsur halogen gas mulia, alkali tanah, unsurunsur periode ketiga dan unsur transisi periode keempat, dan menentukan kadar zat dalam senyawa.
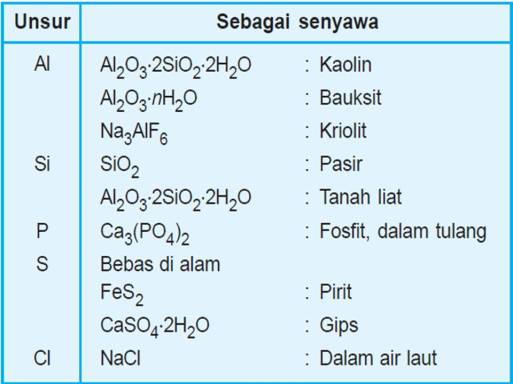
Beberapa unsur logam dan nonlogam, dalam bentuk unsur maupun senyawanya, banyak dimanfaatkan dalam kehidupan sehari-hari. Penggunaan beberapa unsur logam dan nonlogam meningkat dengan berkembang pesatnya industri, baik sebagai alat, bahan dasar, maupun sumber energi. Unsur-unsur logam umumnya diperoleh sebagai bijih logam dalam batuan. Alam Indonesia sangat kaya akan sumber mineral bijih logam, karena itu perlu penguasaan teknologi untuk mengolahnya menjadi logam yang dibutuhkan.
1. Kelimpahan Unsur-Unsur Di Alam
 Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga. Unsur nonlogam juga ada yang dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahanbahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan seharihari. Tidak semua mineral dilakukan pengolahan, tergantung besarnya kandungan unsur di dalamnya dan tingkat kesukaran proses pengolahannya. Dewasa ini orang lebih memilih mendaur ulang aluminium bekas daripada mengambil dari bijihnya karena biayanya lebih murah.
Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga. Unsur nonlogam juga ada yang dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahanbahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan seharihari. Tidak semua mineral dilakukan pengolahan, tergantung besarnya kandungan unsur di dalamnya dan tingkat kesukaran proses pengolahannya. Dewasa ini orang lebih memilih mendaur ulang aluminium bekas daripada mengambil dari bijihnya karena biayanya lebih murah.
 Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga. Unsur nonlogam juga ada yang dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahanbahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan seharihari. Tidak semua mineral dilakukan pengolahan, tergantung besarnya kandungan unsur di dalamnya dan tingkat kesukaran proses pengolahannya. Dewasa ini orang lebih memilih mendaur ulang aluminium bekas daripada mengambil dari bijihnya karena biayanya lebih murah.
Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga. Unsur nonlogam juga ada yang dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahanbahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan seharihari. Tidak semua mineral dilakukan pengolahan, tergantung besarnya kandungan unsur di dalamnya dan tingkat kesukaran proses pengolahannya. Dewasa ini orang lebih memilih mendaur ulang aluminium bekas daripada mengambil dari bijihnya karena biayanya lebih murah.
Tabel 1 : Kelimpahan Unsur Di Alam
1. Komposisi alkali dalam kerak bumi
Logam alkali termasuk logam yang sangat reaktif. Di alam tidak terdapat dalam keadaan bebas, melainkan dalam keadaan terikat dalam bentuk senyawaUnsur yang paling banyak adalah Na dan K. Kedua
unsur ini banyak terdapat dalam air laut dalam bentuk senyawa NaCl dan KCl.
2. Unsur-unsur alkali tanah tidak terdapat bebas di alam, tetapi terdapat dalam bentuk senyawanya
a. Berilium terdapat dalam bijih beril (Be3Al2(SiO3)6).
b. Magnesium sebagai dolomit (MgCO3.CaCO3), karnalit (KCl.MgCl2.6H2O).
c. Kalsium sebagai CaCO3 pada batu kapur dan pualam, batu tahu/gipsum (CaSO4.2H2O).
d. Stronsium sebagai stronsianit (SrCO3) dan galestin (SrSO4).
e. Barium sebagai bijih barit (BaSO4).
Logam alkali termasuk logam yang sangat reaktif. Di alam tidak terdapat dalam keadaan bebas, melainkan dalam keadaan terikat dalam bentuk senyawaUnsur yang paling banyak adalah Na dan K. Kedua
unsur ini banyak terdapat dalam air laut dalam bentuk senyawa NaCl dan KCl.
2. Unsur-unsur alkali tanah tidak terdapat bebas di alam, tetapi terdapat dalam bentuk senyawanya
a. Berilium terdapat dalam bijih beril (Be3Al2(SiO3)6).
b. Magnesium sebagai dolomit (MgCO3.CaCO3), karnalit (KCl.MgCl2.6H2O).
c. Kalsium sebagai CaCO3 pada batu kapur dan pualam, batu tahu/gipsum (CaSO4.2H2O).
d. Stronsium sebagai stronsianit (SrCO3) dan galestin (SrSO4).
e. Barium sebagai bijih barit (BaSO4).
3. Unsur-unsur periode ketiga di alam
4. Unsur-unsur transisi periode keempat di alam
Di alam unsur-unsur transisi periode keempat terdapat dalam senyawa/mineral berupa oksida, sulfida, atau karbonat. Berikut ini tabel beberapa mineral terpenting dari unsur-unsur transisi periode keempat.
Di alam unsur-unsur transisi periode keempat terdapat dalam senyawa/mineral berupa oksida, sulfida, atau karbonat. Berikut ini tabel beberapa mineral terpenting dari unsur-unsur transisi periode keempat.
Sifat-Sifat Unsur
A. Halogen
a. Sifat Kimia Halogen
1) Halogen merupakan golongan yang sangat reaktif dalam menerima elektron dan bertindak sebagai oksidator kuat dalam satu golongan. Makin ke atas, oksidator makin kuat.
2) Keelektronegatifan halogen dalam satu golongan makin ke atas makin besar. Unsur yang paling elektronegatif dibanding unsur lain dalam sistem periodik adalah fluor (perhatikan data keelektronegatifan).
3) Jari-jari atom halogen dalam satu golongan makin ke atas makin kecil (perhatikan data). Ini berarti makin ke atas ukuran molekul makin kecil, maka gaya tarik-menarik antar-molekul (gaya Van der Waals) akan makin kecil. Perhatikan juga titik didih dan titik lelehnya, makin ke atas makin kecil.
1) Halogen merupakan golongan yang sangat reaktif dalam menerima elektron dan bertindak sebagai oksidator kuat dalam satu golongan. Makin ke atas, oksidator makin kuat.
2) Keelektronegatifan halogen dalam satu golongan makin ke atas makin besar. Unsur yang paling elektronegatif dibanding unsur lain dalam sistem periodik adalah fluor (perhatikan data keelektronegatifan).
3) Jari-jari atom halogen dalam satu golongan makin ke atas makin kecil (perhatikan data). Ini berarti makin ke atas ukuran molekul makin kecil, maka gaya tarik-menarik antar-molekul (gaya Van der Waals) akan makin kecil. Perhatikan juga titik didih dan titik lelehnya, makin ke atas makin kecil.
Unsur halogen sangat berbahaya terhadap mata dan tenggorokan. Unsur halogen mempunyai bau yang merangsang dan berwarna. Walaupun brom berwujud cair, tetapi brom mudah sekali menguap. Begitu juga iodium, mudah sekali menyublim.
4) Unsur golongan halogen bersifat oksidator. Urutan kekuatan oksidator halogen dapat dilihat dari data potensial reduksinya:
F2 + 2 e —> 2 F– ; E° = +2,87 V
Cl2 + 2 e —>2 Cl– ; E° = +1,36 V
Br2 + 2 e —>2 Br– ; E° = +1,07 V
I2 + 2 e —> 2 I– ; E° = +0,54 V
Berdasarkan data tersebut, makin ke atas, daya oksidasinya (oksidator) makin kuat. Data ini dapat digunakan untuk memperkirakan apakah reaksi halogen dengan senyawa halida dapat berlangsung atau tidak. Caranya dengan menghitung potensial sel, jika harga potensial sel positif berarti reaksi berlangsung dan jika harga potensial sel negatif berarti reaksi tidak berlangsung.
F2 + 2 e —> 2 F– ; E° = +2,87 V
Cl2 + 2 e —>2 Cl– ; E° = +1,36 V
Br2 + 2 e —>2 Br– ; E° = +1,07 V
I2 + 2 e —> 2 I– ; E° = +0,54 V
Berdasarkan data tersebut, makin ke atas, daya oksidasinya (oksidator) makin kuat. Data ini dapat digunakan untuk memperkirakan apakah reaksi halogen dengan senyawa halida dapat berlangsung atau tidak. Caranya dengan menghitung potensial sel, jika harga potensial sel positif berarti reaksi berlangsung dan jika harga potensial sel negatif berarti reaksi tidak berlangsung.
5) Mempunyai bilangan oksidasi lebih dari satu, kecuali fluor.
B. Sifat Fisika Halogen

II. Gas Mulia
 Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban). Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF6. Dalam waktu yang singkat ahli kimia yang lain menunjukkan bahwa Xenon dapat bereaksi langsung dengan Fluor membentuk XeF2, XeF4, dan XeF6. Sejak saat itu istilah inert tidak lagi sesuai dan para ahli kimia mulai menyebut dengan golongan gas mulia.
Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban). Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF6. Dalam waktu yang singkat ahli kimia yang lain menunjukkan bahwa Xenon dapat bereaksi langsung dengan Fluor membentuk XeF2, XeF4, dan XeF6. Sejak saat itu istilah inert tidak lagi sesuai dan para ahli kimia mulai menyebut dengan golongan gas mulia.
 Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban). Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF6. Dalam waktu yang singkat ahli kimia yang lain menunjukkan bahwa Xenon dapat bereaksi langsung dengan Fluor membentuk XeF2, XeF4, dan XeF6. Sejak saat itu istilah inert tidak lagi sesuai dan para ahli kimia mulai menyebut dengan golongan gas mulia.
Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban). Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF6. Dalam waktu yang singkat ahli kimia yang lain menunjukkan bahwa Xenon dapat bereaksi langsung dengan Fluor membentuk XeF2, XeF4, dan XeF6. Sejak saat itu istilah inert tidak lagi sesuai dan para ahli kimia mulai menyebut dengan golongan gas mulia.
1. Sifat Gas Mulia
Unsur gas mulia terdapat sebagai gas tak berwarna yang monoatomik, ini erat kaitannya dengan struktur elektron oktet dan duplet dari gas mulia. Sedangkan wujud gas pada suhu kamar disebabkan titik cair dan titik didih gas mulia yang rendah.
@Titik cair dan titik didih
Titik cair dan titik didih gas mulia meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar atom gas mulia sesuai bertambahnya massa atom relatif (Ar).
@Kelarutan
Kelarutan gas mulia dalam air bertambah besar dari Helium (He) hingga Radon (Rn). Pada suhu 0 °C dalam 100 ml air terlarut 1 ml He, 6 ml Ar, dan 50 ml Rn.
@ Unsur-unsur gas mulia mengandung 8 elektron pada kulit terluarnya kecuali He mengandung 2 elektron.
@ Energi ionisasinya sangat tinggi, akibatnya unsurunsur gas mulia sukar bereaksi dengan unsurunsur lainnya.
@ Molekul gas mulia monoatomik.
C. Alkali
1. Sifat Fisis Alkali
Dapat dilihat bahwa sebagai logam, golongan alkali tanah mempunyai sifat yang tidak biasa, yaitu titik lelehnya yang relatif rendah, rapatannya yang relatif rendah, dan kelunakannya. Semua unsur logam alkali ini dapat dengan mudah diubah bentuknya dengan memencetnya di antara jempol dan jari telunjuk (dengan melindungi kulit baik-baik). Unsur-unsur pada golongan ini mempunyai energi ionisasi dan keelektronegatifan ratarata yang paling rendah. Hal ini dikarenakan ukuran atom dan jarak yang relatif besar antara elektron terluar dengan inti
2. Sifat Kimia Alkali
III. Logam Alkali Tanah
1.Sifat Fisis Alkali Tanah
Unsur logam alkali tanah (IIA) ini terdiri dari Be, Mg, Ca, Sr, Ba, dan Ra. Golongan ini mempunyai sifat-sifat yang mirip dengan golongan IA. Perbedaannya adalah bahwa golongan IIA ini mempunyai konfigurasi elektron ns2 dan merupakan reduktor yang kuat. Meskipun lebih keras dari golongan IA, tetapi golongan IIA ini tetap relatif lunak, perak mengkilat, dan mempunyai titik leleh dan kerapatan lebih tinggi.
Unsur-unsur logam alkali tanah agak lebih keras, kekerasannya berkisar dari barium yang kira-kira sama keras dengan timbal, sampai berilium yag cukup keras untuk menggores kebanyakan logam lainnya. Golongan ini mempunyai struktur elektron yang sederhana, unsur-unsur logam alkali tanah mempunyai 2 elektron yang relatif mudah dilepaskan. Selain energi ionisasi yang relatif rendah, keelektronegatifan rata-rata golongan ini juga rendah dikarenakan ukuran atomnya dan jarak yang relatif besar antara elektron terluar dengan inti
2. Sifat Kimia Alkali Tanah
D. Unsur Perioda Ketiga
Sifat Fisika dan Kimia
@Sifat Fisika Unsur-unsur Periode Ketiga
Unsur-unsur yang ada di dalam periode ketiga terdiri dari unsur logam (Na, Mg, Al), metaloid (Si), nonlogam (P, S, Cl), dan gas mulia (Ar). Keelektronegatifan unsur-unsur periode ketiga semakin ke kanan semakin besar diakibatkan oleh jari-jari atomnya yang semakin ke kanan semakin kecil. Kekuatan ikatan antaratom dalam logam meningkat (dari Na ke Al). Hal ini berkaitan dengan pertambahan elektron valensinya. Silikon merupakan semikonduktor/isolator karena
termasuk metaloid. Unsur ini mempunyai ikatan kovalen yang sangat besar, begitu juga dengan fosfor, belerang, dan klorin yang merupakan isolator karena termasuk unsur nonlogam (Sumber:http://www.chem-is-try.org).
Unsur-unsur yang ada di dalam periode ketiga terdiri dari unsur logam (Na, Mg, Al), metaloid (Si), nonlogam (P, S, Cl), dan gas mulia (Ar). Keelektronegatifan unsur-unsur periode ketiga semakin ke kanan semakin besar diakibatkan oleh jari-jari atomnya yang semakin ke kanan semakin kecil. Kekuatan ikatan antaratom dalam logam meningkat (dari Na ke Al). Hal ini berkaitan dengan pertambahan elektron valensinya. Silikon merupakan semikonduktor/isolator karena
termasuk metaloid. Unsur ini mempunyai ikatan kovalen yang sangat besar, begitu juga dengan fosfor, belerang, dan klorin yang merupakan isolator karena termasuk unsur nonlogam (Sumber:http://www.chem-is-try.org).
@Sifat Kimia Unsur-unsur Periode Ketiga
Natrium merupakan reduktor terkuat, sedangkan klorin merupakan oksidator terkuat. Meskipun natrium, magnesium, dan aluminium merupakan reduktor kuat, tetapi kereaktifannya berkurang dari Na ke Al. Sedangkan silikon merupakan reduktor yang sangat lemah, jadi hanya dapat bereaksi dengan oksidator-oksidator kuat, misalnya klorin dan oksigen. Di lain pihak selain sebagai reduktor, fosfor juga merupakan oksidator lemah yang dapat mengoksidasi reduktor kuat, seperti logam aktif. Sedangkan belerang yang mempunyai daya reduksi lebih lemah daripada fosfor ternyata mempunyai daya pengoksidasi lebih kuat daripada fosfor. Sementara klorin dapat mengoksidasi hampir semua logam dan nonlogam karena klorin adalah oksidator kuat.Unsur-unsur periode ketiga, yaitu NaOH, Mg(OH)2, Al(OH)3, H2SiO3, H3PO4, H2SO4, dan HClO4.
Natrium merupakan reduktor terkuat, sedangkan klorin merupakan oksidator terkuat. Meskipun natrium, magnesium, dan aluminium merupakan reduktor kuat, tetapi kereaktifannya berkurang dari Na ke Al. Sedangkan silikon merupakan reduktor yang sangat lemah, jadi hanya dapat bereaksi dengan oksidator-oksidator kuat, misalnya klorin dan oksigen. Di lain pihak selain sebagai reduktor, fosfor juga merupakan oksidator lemah yang dapat mengoksidasi reduktor kuat, seperti logam aktif. Sedangkan belerang yang mempunyai daya reduksi lebih lemah daripada fosfor ternyata mempunyai daya pengoksidasi lebih kuat daripada fosfor. Sementara klorin dapat mengoksidasi hampir semua logam dan nonlogam karena klorin adalah oksidator kuat.Unsur-unsur periode ketiga, yaitu NaOH, Mg(OH)2, Al(OH)3, H2SiO3, H3PO4, H2SO4, dan HClO4.
Sifat hidroksida unsur-unsur periode ketiga tergantung pada energi ionisasinya. Hal ini dapat dilihat dari jenis ikatannya. Jika ikatan M – OH bersifat ionik dan hidroksidanya bersifat basa karena akan melepas ion OH– dalam air, maka energi ionisasinya rendah. Tetapi jika ikatan M – OH bersifat kovalen dan tidak lagi dapat melepas ion OH–, maka energi ionisasinya besar. NaOH tergolong basa kuat dan mudah larut dalam air, Mg(OH)2 lebih lemah daripada NaOH tetapi masih termasuk basa kuat. Namun Al(OH)3 bersifat amfoter, artinya dapat bersifat asam sekaligus basa. Hal ini berarti bila Al(OH)3 berada pada lingkungan basa kuat, maka akan bersifat sebagai asam, sebaliknya jika berada pada lingkungan asam kuat, maka akan bersifat sebagai basa. Sedangkan H2SiO3 atau Si(OH)4, merupakan asam lemah dan tidak stabil, mudah terurai menjadi SiO2 dan H2O. Begitu pula dengan H3PO4 atau P(OH)5 yang juga merupakan asam lemah. Sementara H2SO4 atau S(OH)6 merupakan asam kuat, begitu juga HClO4 atau Cl(OH)7 yang merupakan asam sangat kuat.
E. Unsur Transisi
Pada sistem periodik unsur, yang termasuk dalam golongan transisi adalah unsur-unsur golongan B, dimulai dari IB – VIIB dan VIII. Sesuai dengan pengisian elektron pada subkulitnya, unsur ini termasuk unsur blok d, yaitu unsur-unsur dengan elektron valensi yang terletak pada subkulit d dalam konfigurasi elektronnya. Pada bagian ini unsur-unsur transisi yang akan dibahas adalah unsur transisi pada periode 4, yang terdiri dari skandium (Sc), titanium (Ti), vanadium (V), krom (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel (Ni), tembaga (Cu), dan seng (Zn).
1. Sifat Logam Transisi
Semua unsur transisi adalah logam, yang bersifat lunak, mengkilap, dan penghantar listrik dan panas yang baik. Perak merupakan unsur transisi yang mempunyai konduktivitas listrik paling tinggi pada suhu kamar dan tembaga di tempat kedua. Dibandingkan dengan golongan IA dan IIA, unsur logam transisi lebih keras, punya titik leleh, titik didih, dan kerapatan lebih tinggi. Hal ini disebabkan karena unsur transisi berbagi elektron pada kulit d dan s, sehingga ikatannya semakin kuat.
1. Sifat Logam Transisi
Semua unsur transisi adalah logam, yang bersifat lunak, mengkilap, dan penghantar listrik dan panas yang baik. Perak merupakan unsur transisi yang mempunyai konduktivitas listrik paling tinggi pada suhu kamar dan tembaga di tempat kedua. Dibandingkan dengan golongan IA dan IIA, unsur logam transisi lebih keras, punya titik leleh, titik didih, dan kerapatan lebih tinggi. Hal ini disebabkan karena unsur transisi berbagi elektron pada kulit d dan s, sehingga ikatannya semakin kuat.
2. Bilangan Oksidasi
Tidak seperti golongan IA dan IIA yang hanya mempunyai bilangan oksidasi +1 dan +2, unsur-unsur logam transisi mempunyai beberapa bilangan oksidasi. Seperti vanadium yang punya bilangan oksidasi +2, +3, dan +4.
Tidak seperti golongan IA dan IIA yang hanya mempunyai bilangan oksidasi +1 dan +2, unsur-unsur logam transisi mempunyai beberapa bilangan oksidasi. Seperti vanadium yang punya bilangan oksidasi +2, +3, dan +4.
3. Sifat Kemagnetan
Setiap atom dan molekul mempunyai sifat magnetik, yaitu paramagnetik, di mana atom, molekul, atau ion sedikit dapat ditarik oleh medan magnet karena ada elektron yang tidak berpasangan pada orbitalnya dan diamagnetik, di mana atom, molekul, atau ion dapat ditolak oleh medan magnet karena seluruh elektron pada orbitnya berpasangan. Sedangkan pada umumnya unsur-unsur transisi bersifat paramagnetik karena mempunyai elektron yang tidak berpasangan pada orbital-orbital d-nya. Sifat paramagnetik ini akan semakin kuat jika jumlah elektron yang tidak berpasangan pada orbitalnya semakin banyak. Logam Sc, Ti, V, Cr, dan Mn bersifat paramagnetik, sedangkan Cu dan Zn bersifat diamagnetik. Untuk Fe, Co, dan Ni bersifat feromagnetik, yaitu kondisi yang sama dengan paramagnetik hanya saja dalam keadaan padat.
Setiap atom dan molekul mempunyai sifat magnetik, yaitu paramagnetik, di mana atom, molekul, atau ion sedikit dapat ditarik oleh medan magnet karena ada elektron yang tidak berpasangan pada orbitalnya dan diamagnetik, di mana atom, molekul, atau ion dapat ditolak oleh medan magnet karena seluruh elektron pada orbitnya berpasangan. Sedangkan pada umumnya unsur-unsur transisi bersifat paramagnetik karena mempunyai elektron yang tidak berpasangan pada orbital-orbital d-nya. Sifat paramagnetik ini akan semakin kuat jika jumlah elektron yang tidak berpasangan pada orbitalnya semakin banyak. Logam Sc, Ti, V, Cr, dan Mn bersifat paramagnetik, sedangkan Cu dan Zn bersifat diamagnetik. Untuk Fe, Co, dan Ni bersifat feromagnetik, yaitu kondisi yang sama dengan paramagnetik hanya saja dalam keadaan padat.
4. Ion Berwarna
Tingkat energi elektron pada unsur-unsur transisi yang hampir sama menyebabkan timbulnya warna pada ion-ion logam transisi. Hal ini terjadi karena elektron dapat bergerak ke tingkat yang lebih tinggi dengan mengabsorpsi sinar tampak. Pada golongan transisi, subkulit 3d yang belum terisi penuh menyebabkan elektron pada subkulit itu menyerap energi cahaya, sehingga elektronnya tereksitasi dan memancarkan energi cahaya dengan warna yang sesuai dengan warna cahaya yang dapat dipantulkan pada saat kembali ke keadaan dasar. Misalnya Ti2+ berwarna ungu, Ti4+ tidak berwarna, Co2+ berwarna merah muda, Co3+ berwarna biru, dan lain sebagainya.
Tingkat energi elektron pada unsur-unsur transisi yang hampir sama menyebabkan timbulnya warna pada ion-ion logam transisi. Hal ini terjadi karena elektron dapat bergerak ke tingkat yang lebih tinggi dengan mengabsorpsi sinar tampak. Pada golongan transisi, subkulit 3d yang belum terisi penuh menyebabkan elektron pada subkulit itu menyerap energi cahaya, sehingga elektronnya tereksitasi dan memancarkan energi cahaya dengan warna yang sesuai dengan warna cahaya yang dapat dipantulkan pada saat kembali ke keadaan dasar. Misalnya Ti2+ berwarna ungu, Ti4+ tidak berwarna, Co2+ berwarna merah muda, Co3+ berwarna biru, dan lain sebagainya.
Beberapa kegunaan unsur-unsur transisi
a. Skandium, digunakan pada lampu intensitas tinggi.
b. Titanium, digunakan pada industri pesawat terbang dan industri kimia (pemutih kertas, kaca, keramik, dan kosmetik).
c. Vanadium, digunakan sebagai katalis pada pembuatan asam sulfat.
d. Kromium, digunakan sebagai plating logam-logam lainnya.
e. Mangan, digunakan pada produksi baja dan umumnya alloy manganbesi.
f. Besi, digunakan pada perangkat elektronik.
g. Kobalt, digunakan untuk membuat aliansi logam.
h. Nikel, digunakan untuk melapisi logam supaya tahan karat, membuat monel.
i. Tembaga, digunakan pada alat-alat elektronik dan perhiasan.
j. Seng, digunakan sebagai bahan cat putih, antioksidan pada pembuatan ban mobil, dan bahan untuk melapisi tabung gambar televisi.
a. Skandium, digunakan pada lampu intensitas tinggi.
b. Titanium, digunakan pada industri pesawat terbang dan industri kimia (pemutih kertas, kaca, keramik, dan kosmetik).
c. Vanadium, digunakan sebagai katalis pada pembuatan asam sulfat.
d. Kromium, digunakan sebagai plating logam-logam lainnya.
e. Mangan, digunakan pada produksi baja dan umumnya alloy manganbesi.
f. Besi, digunakan pada perangkat elektronik.
g. Kobalt, digunakan untuk membuat aliansi logam.
h. Nikel, digunakan untuk melapisi logam supaya tahan karat, membuat monel.
i. Tembaga, digunakan pada alat-alat elektronik dan perhiasan.
j. Seng, digunakan sebagai bahan cat putih, antioksidan pada pembuatan ban mobil, dan bahan untuk melapisi tabung gambar televisi.
Warna Unsur Transisi Beserta Bilangan Oksidasi nya
Manfaat Unsur dan Senyawanya
MANFAAT UNSUR DAN SENYAWANYA
1. Halogen
kegunaannya:
CCl2F2 : Gas freon (freon–12) digunakan sebagai zat pendingin pada lemari es dan AC.
NaF : Natrium fluorida digunakan sebagai obat penguat pada kayu.
DDT : Dikloro Difenil Trikloro etana digunakan sebagai insektisida.
PVC : Polivinil klorida digunakan sebagai plastik untuk pipa pralon.
CaOCl2 : Digunakan sebagai serbuk pengelantang dan desinfektan.
NaClO : Kaporit sebagai serbuk pengelantang
KClO3 : Digunakan dalam industri korek api.
KCl : Digunakan untuk pupuk.
NaBr : Digunakan dalam kedokteran sebagai obat penenang.
CCl2F2 : Gas freon (freon–12) digunakan sebagai zat pendingin pada lemari es dan AC.
NaF : Natrium fluorida digunakan sebagai obat penguat pada kayu.
DDT : Dikloro Difenil Trikloro etana digunakan sebagai insektisida.
PVC : Polivinil klorida digunakan sebagai plastik untuk pipa pralon.
CaOCl2 : Digunakan sebagai serbuk pengelantang dan desinfektan.
NaClO : Kaporit sebagai serbuk pengelantang
KClO3 : Digunakan dalam industri korek api.
KCl : Digunakan untuk pupuk.
NaBr : Digunakan dalam kedokteran sebagai obat penenang.
Pembuatan:
Unsur-unsur halogen dapat dibuat dengan jalan oksidasi, reduksi, dan elektrolisis.
Klor :
Unsur-unsur halogen dapat dibuat dengan jalan oksidasi, reduksi, dan elektrolisis.
Klor :
– Oksidasi, Dengan memanaskan campuran MnO2, NaCl, dan H2SO4 pekat.
– Elektrolisis lebur NaCl menghasilkan gaS klor di anode.
– Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
– Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
– Elektrolisis lebur NaCl menghasilkan gaS klor di anode.
– Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
– Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
Brom :
– Oksidasi, Dengan mengalirkan gas Cl2 ke dalam air laut.
Cl2(g) + 2 Br–(aq) —> 2 Cl–(aq) + Br2(aq)
Iodium :
Iodium :
– Reduksi
Dengan menambah NaHSO3 ke dalam larutan NaIO3
Dengan menambah NaHSO3 ke dalam larutan NaIO3
2 IO3–(aq) + 5 HSO3 –(aq) —>3 HSO4 –(aq) +2 SO42–(aq) + H2O(l) + I2(aq)
2. Nitrogen dan Oksigen
 a. Nitrogen
a. NitrogenDalam keadaan bebas terdapat di udara (± 78%); dalam keadaan terikat sebagai KNO3 dan NaNO3 (sendawa Chili).
Pembuatan:
Dalam teknik/industri: dengan distilasi udara cair.
Dalam laboratorium : dengan memanaskan NH4NO2
NH4NO2(s) —> 2 H2O(l) + N2(g)
Senyawa yang penting:
NH3 : dibuat dengan Proses Haber–Bosch
N2(g) + 3 H2(g) —> 2 NH3(g)
Sebagai bahan baku pembuatan pupuk urea.
HNO3 (asam nitrat): dibuat dengan proses Ostwald.
 b. Oksigen
b. OksigenPembuatan oksigen:
1) Proses elektrolisis air.
2) Proses penyulingan udara.
3) Memanaskan garam tertentu dan oksida logam berat
2 KClO3(s) —>2 KCl(s) + 3 O2(g)
2 HgO(s) —> 2 Hg(l) + O2(g)
3. Alkali dan alkali tanah
 a. Senyawa-senyawa alkali
a. Senyawa-senyawa alkaliNaOH : Disebut soda api. Digunakan sebagai bahan baku untuk pembuatan sabun, detergen, kertas, serat rayon.
Na2CO3: Natrium karbonat dikenal dengan nama soda. Digunakan dalam industri kaca, melunakkan air sadah dan menghilangkan noda minyak.
NaHCO3: Natrium bikarbonat juga disebut soda kue. Digunakan untuk pembuatan kue.
Pembuatan:
Logam alkali dibuat dengan elektrolisis cairan garamnya
(sebagai klorida).
Reaksi : LCl(l) –> L+ + Cl–
Katode : L+ + e– –> L
Anode : 2 Cl– –> Cl2 + 2 e–
Logam alkali dibuat dengan elektrolisis cairan garamnya
(sebagai klorida).
Reaksi : LCl(l) –> L+ + Cl–
Katode : L+ + e– –> L
Anode : 2 Cl– –> Cl2 + 2 e–
b. Senyawa-senyawa alkali tanah
 1) Magnesium oksida (MgO)
1) Magnesium oksida (MgO)
Digunakan untuk bahan gading tiruan, obat penyakit mag, dan pelapis tanur.
 1) Magnesium oksida (MgO)
1) Magnesium oksida (MgO)Digunakan untuk bahan gading tiruan, obat penyakit mag, dan pelapis tanur.
2) Magnesium sulfat berkristal (MgSO4.7H2O)
Digunakan sebagai obat kuras dengan nama garam inggris.
Digunakan sebagai obat kuras dengan nama garam inggris.
3) Kalsium oksida (CaO)
Kalsium oksida disebut juga kapur tohor atau gamping. Digunakan dalam industri besi, semen, soda, kaca.
Kalsium oksida disebut juga kapur tohor atau gamping. Digunakan dalam industri besi, semen, soda, kaca.
4) Kalsium karbida (CaC2)
Kalsium karbida disebut juga karbit, digunakan untuk membuat gas asetilen.
5) Kalsium sulfat (CaSO4)
Kalsium sulfat yang mengandung 2 molekul air kristal disebut batu tahun (CaSO4.2H2O).
Kalsium karbida disebut juga karbit, digunakan untuk membuat gas asetilen.
5) Kalsium sulfat (CaSO4)
Kalsium sulfat yang mengandung 2 molekul air kristal disebut batu tahun (CaSO4.2H2O).
Pembuatan:
Logam alkali tanah dibuat dengan elektrolisis garam klorida cairannya.
MCl2 –> M2+ + 2 Cl–
Katode : M2+ + 2 e– –>M
Anode : 2 Cl– –>Cl2 + 2 e–
Logam alkali tanah dibuat dengan elektrolisis garam klorida cairannya.
MCl2 –> M2+ + 2 Cl–
Katode : M2+ + 2 e– –>M
Anode : 2 Cl– –>Cl2 + 2 e–
4. Unsur-unsur Periode Ketiga
 Pembuatan dan kegunaannya
Pembuatan dan kegunaannyaa. Natrium
Dibuat dengan cara elektrolisis leburan NaCl
Reaksi : NaCl(l) –>Na+ + Cl–
Katode : Na+ + e– –>Na
Anode : 2 Cl –> Cl2 + 2 e–
Natrium tidak dapat dibuat dengan elektrolisis air laut. Natrium disimpan dalam minyak tanah.
Kegunaannya:
Sebagai lampu penerangan di jalan-jalan raya. Natrium mempunyai kemampuan menembus kabut.
b. Magnesium
Dibuat dengan cara elektrolisis lelehan MgCl2.
Kegunaannya:
Untuk aliase (magnalium), digunakan untuk kerangka pesawat terbang dan lampu kilat dalam fotografi.
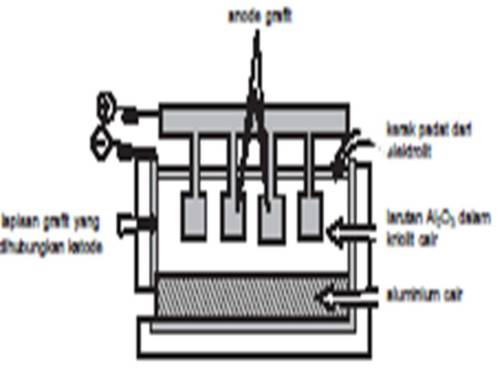
c. Aluminium
Dibuat dengan elektrolisis dari bauksit yang murni.
1) Al2O3 murni dicampur dengan Na3AIF (kriolit) untuk menurunkan titik leleh Al2O3 dan bertindak sebagai pelarut untuk pemurnian Al2O3.
2) Dielektrolisis, reaksi yang terjadi:
Al2O3 –>Al3+ + O2–
Katode (grafit) : 4 Al3+ + 12 e– –>4 Al
Anode (grafit) : 3 C + 6 O2– —>3 CO2 + 12 e–
3 C + 4 Al3+ + 6 O2– —>4 Al + 3 CO2
Anode sedikit demi sedikit akan habis.
d. Silikon
Dibuat dengan mereduksi SiO2 dengan karbon
Dibuat dengan mereduksi SiO2 dengan karbon
30000C
SiO2 + C ——-> Si + 2CO
SiO2 + C ——-> Si + 2CO
Kegunaannya:
– Bahan bakar pada pembuatan jenis-jenis gelas atau kaca.
– Bahan-bahan solar sel.
– Sebagai semikonduktor.
– Bahan bakar pada pembuatan jenis-jenis gelas atau kaca.
– Bahan-bahan solar sel.
– Sebagai semikonduktor.
e. Fosfor
Dibuat dengan Proses Wohler
Dikenal dalam 2 bentuk alotropi, yaitu fosfor putih dan fosfor merah.
Kegunaannya:
– Bahan untuk membuat pupuk superfosfat.
– Bahan untuk membuat korek api.
Dibuat dengan Proses Wohler
Dikenal dalam 2 bentuk alotropi, yaitu fosfor putih dan fosfor merah.
Kegunaannya:
– Bahan untuk membuat pupuk superfosfat.
– Bahan untuk membuat korek api.
f. Belerang
Terdapat bebas di alam, terutama di daerah gunung berapi. Dikenal dalam 2 bentuk alotropi, yaitu monoklin (di atas suhu 96 °C) dan rombik (di bawah suhu 96 °C).
Kegunaannya:
Sebagai bahan baku pembuatan asam sulfat H2SO4 (Proses Kontak dan Proses Kamar Timbal).
1) Asam sulfat (H2SO4)
Asam sulfat adalah zat cair kental, tak berwarna, bersifat sangat higroskopis. Asam sulfat dapat menarik hidrogen dan oksigen dari senyawanya dengan perbandingan 2 : 1. Senyawa-senyawa yang mengandung H dan O seperti gula, selulosa, dan kayu akan hangus bila dituangi asam sulfat pekat. Selain bersifat higroskopis, asam sulfat pekat merupakan oksidator kuat.
2) Pembuatan asam sulfat
Dalam dunia industri asam sulfat dibuat dengan2 cara, yaitu:
a) Menurut proses kontak.
b) Menurut proses bilik timbal/kamar timbal.
Proses kontak dengan proses kamar timbal mempunyai persamaan dan perbedaan.
Terdapat bebas di alam, terutama di daerah gunung berapi. Dikenal dalam 2 bentuk alotropi, yaitu monoklin (di atas suhu 96 °C) dan rombik (di bawah suhu 96 °C).
Kegunaannya:
Sebagai bahan baku pembuatan asam sulfat H2SO4 (Proses Kontak dan Proses Kamar Timbal).
1) Asam sulfat (H2SO4)
Asam sulfat adalah zat cair kental, tak berwarna, bersifat sangat higroskopis. Asam sulfat dapat menarik hidrogen dan oksigen dari senyawanya dengan perbandingan 2 : 1. Senyawa-senyawa yang mengandung H dan O seperti gula, selulosa, dan kayu akan hangus bila dituangi asam sulfat pekat. Selain bersifat higroskopis, asam sulfat pekat merupakan oksidator kuat.
2) Pembuatan asam sulfat
Dalam dunia industri asam sulfat dibuat dengan2 cara, yaitu:
a) Menurut proses kontak.
b) Menurut proses bilik timbal/kamar timbal.
Proses kontak dengan proses kamar timbal mempunyai persamaan dan perbedaan.
1) Persamaan : bahan dasar SO2 dari pembakaran belerang.
2) Perbedaan : katalis yang digunakan pada proses kamar timbal adalah campuran NO dan NO2 (uap nietreusa).
Hasil kemurniannya:
1) Proses kontak : 98–100%
2) Proses kamar timbal : ± 77%
2) Perbedaan : katalis yang digunakan pada proses kamar timbal adalah campuran NO dan NO2 (uap nietreusa).
Hasil kemurniannya:
1) Proses kontak : 98–100%
2) Proses kamar timbal : ± 77%
1) Proses kontak
Bahan baku asam sulfat adalah gas SO2 yang diperoleh dengan pemanggangan pirit atau pembakaran arang.
Reaksinya: 4 FeS2 + 11 O2 —> 2 Fe2O3 + 8 SO2 atau: S + O2 —> SO2
Gas belerang dioksidasi yang terjadi dicampur dengan udara dialirkan melalui katalisator kontak(V2O5) pada suhu ± 400 °C.
Dalam tanur kontak, gas SO2 + O2 diembuskan ke dalam tanur hingga bersentuhan dengan lempenglempeng yang dilapis V2O5 dalam tanur tersebut sebagai zat kontak.
Bahan baku asam sulfat adalah gas SO2 yang diperoleh dengan pemanggangan pirit atau pembakaran arang.
Reaksinya: 4 FeS2 + 11 O2 —> 2 Fe2O3 + 8 SO2 atau: S + O2 —> SO2
Gas belerang dioksidasi yang terjadi dicampur dengan udara dialirkan melalui katalisator kontak(V2O5) pada suhu ± 400 °C.
Dalam tanur kontak, gas SO2 + O2 diembuskan ke dalam tanur hingga bersentuhan dengan lempenglempeng yang dilapis V2O5 dalam tanur tersebut sebagai zat kontak.
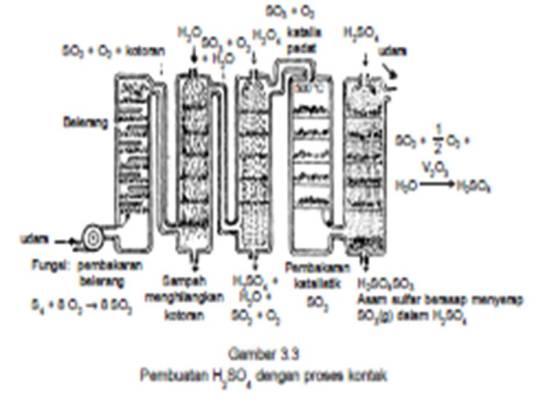 Dalam reaksi ini V2O5 tidak hanya bertindak sebagai katalis, tetapi juga bertindak sebagai oksidator. Oleh karena itu, dalam proses kontak V2O5 bertindak sebagai katalis oksidator. Gas SO3 yang terjadi dialirkan ke dalam larutan asam sulfat encer, sehingga terjadi asam pirosulfat.
Dalam reaksi ini V2O5 tidak hanya bertindak sebagai katalis, tetapi juga bertindak sebagai oksidator. Oleh karena itu, dalam proses kontak V2O5 bertindak sebagai katalis oksidator. Gas SO3 yang terjadi dialirkan ke dalam larutan asam sulfat encer, sehingga terjadi asam pirosulfat.Reaksinya: SO3 + H2SO4 —> H2S2O7
Dengan menambahkan air ke dalam campuran ini diperoleh asam sulfat pekat (98%).
Reaksinya: H2S2O7 + H2O —> 2 H2SO4
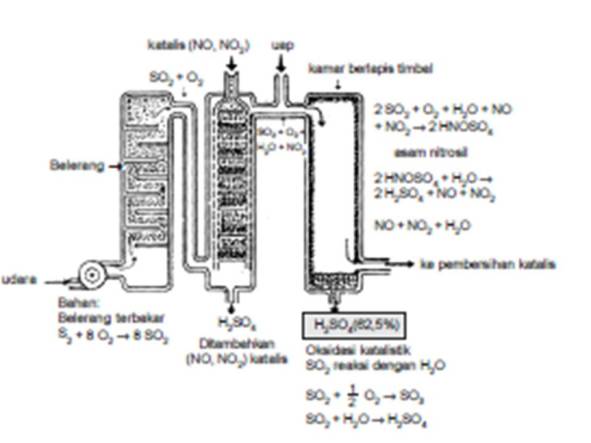
2) Proses bilik timbal
Bahan baku dalam proses ini sama seperti pada proses kontak yaitu gas SO2. Katalis yang digunakan pada proses ini ialah gas NO dan NO2. Gas SO2, NO, NO2, dan uap air dialirkan ke dalam ruang yang bagian dalamnya dilapisi Pb (timbal).
Reaksi yang terjadi:
2 S(s) + 2 O2(g) —> 2 SO2(g)
2 SO2(g) + 2 NO2(g) —> 2 SO3(g) + 2 NO(g)
2 SO3(g) + 2 H2O(l) —> 2 H2SO4(aq)
2 NO(g) + O2(g) —> 2 NO2(g)
Reaksi total:
2 S(s) + 2 O2(g) + 2 H2O(l) + 2 H2O(l) —>2 H2SO4(aq)
 g. Klor
g. KlorDapat dibuat dengan elektrolisis leburan NaCl atau elektrolisis larutan NaCl dengan menggunakan diafragma.
Kegunaannya:
Sebagai desinfektan (Ca(OCl)2), pemutih NaClO.
h. Argon
Digunakan sebagai pengisi bola lampu listrik dalam pengelasan dan pencegahan perkaratan.
5. Unsur-Unsur Transisi

SOAL – SOAL
SOAL – SOAL
1. Tiga unsur yang paling melimpah di muka bumi adalah … .
A. oksigen, nitrogen, dan klorida
B. silikon, argon, dan natrium
C. oksigen, silikon, dan aluminium
D. nitrogen, aluminium, dan natrium
E. oksigen, silikon, dan nitrogen
A. oksigen, nitrogen, dan klorida
B. silikon, argon, dan natrium
C. oksigen, silikon, dan aluminium
D. nitrogen, aluminium, dan natrium
E. oksigen, silikon, dan nitrogen
2. Logam yang paling melimpah di bumi adalah … .
A. natrium D. seng
B. besi E. magnesium
C. krom
A. natrium D. seng
B. besi E. magnesium
C. krom
3. Yang berwujud gas pada golongan halogen adalah … .
A. brom dan iodin
B. klor dan iodin
C. fluor dan klor
D. fluor dan brom
E. brom dan klor
A. brom dan iodin
B. klor dan iodin
C. fluor dan klor
D. fluor dan brom
E. brom dan klor
4. Unsur yang tidak dapat membentuk asam oksi adalah … .
A. fluor D. iodin
B. klor E. astatin
C. brom
A. fluor D. iodin
B. klor E. astatin
C. brom
5. Unsur logam alkali yang mempunyai keelektronegatifan paling besar adalah … .
A. natrium
B. litium
C. kalium
D. rubidium
E. sesium
A. natrium
B. litium
C. kalium
D. rubidium
E. sesium
6. Logam alkali tidak dapat bereaksi dengan … .
A. udara D. logam
B. air E. halogen
C. asam kuat
A. udara D. logam
B. air E. halogen
C. asam kuat
7. Berikut ini merupakan logam alkali tanah, kecuali … .
A. magnesium D. berilium
B. barium E. radium
C. boron
A. magnesium D. berilium
B. barium E. radium
C. boron
8. Unsur logam alkali tanah yang bersifat amfoter adalah … .
A. berilium D. barium
B. magnesium E. radium
C. kalsium
A. berilium D. barium
B. magnesium E. radium
C. kalsium
9. Unsur pada periode ketiga yang merupakan oksidator paling kuat adalah … .
A. natrium D. silikon
B. magnesium E. klor
C. aluminium
A. natrium D. silikon
B. magnesium E. klor
C. aluminium
10. Unsur transisi periode 4 yang mempunyai sifat paramagnetik adalah … .
A. skandium, titanium, dan krom
B. tembaga, seng, dan vanadium
C. besi, kobalt, dan nikel
D. vanadium, krom, dan mangan
E. skandium, vanadium, dan mangan
A. skandium, titanium, dan krom
B. tembaga, seng, dan vanadium
C. besi, kobalt, dan nikel
D. vanadium, krom, dan mangan
E. skandium, vanadium, dan mangan
11. Unsur yang dapat digunakan untuk melapisi logam agar tahan karat adalah … .
A. skandium dan titanium
B. krom dan nikel
C. nikel dan kobalt
D. vanadium dan mangan
E. tembaga dan krom
A. skandium dan titanium
B. krom dan nikel
C. nikel dan kobalt
D. vanadium dan mangan
E. tembaga dan krom
12. Pembuatan asam sulfat menurut proses kontak dilakukan dengan kondisi … .
A. suhu dan tekanan rendah dengan katalisator V2O5
B. tekanan rendah, suhu sekitar 500 °C, katalisator NO2
C. tekanan 150 – 200 atm, suhu rendah, katalisator V2O5
D. tekanan rendah, suhu sekitar 500 °C, katalisator V2O5
E. tekanan 150 – 200 atm, suhu sekitar 500 °C, katalisator V2O5
A. suhu dan tekanan rendah dengan katalisator V2O5
B. tekanan rendah, suhu sekitar 500 °C, katalisator NO2
C. tekanan 150 – 200 atm, suhu rendah, katalisator V2O5
D. tekanan rendah, suhu sekitar 500 °C, katalisator V2O5
E. tekanan 150 – 200 atm, suhu sekitar 500 °C, katalisator V2O5
13. Unsur-unsur gas mulia memiliki sifat-sifat berikut, kecuali ….
A. memiliki 8 elektron di kulit terluarnya
B. terdapat sebagai unsur bebas monoatomik
C. memiliki energi ionisasi yang relatif tinggi
D. sukar bereaksi dengan unsur lain
E. dapat dipisahkan dari udara dengan destilasi bertingkat
A. memiliki 8 elektron di kulit terluarnya
B. terdapat sebagai unsur bebas monoatomik
C. memiliki energi ionisasi yang relatif tinggi
D. sukar bereaksi dengan unsur lain
E. dapat dipisahkan dari udara dengan destilasi bertingkat
14. Unsur halogen tidak terdapat dalam keadaan bebas di alam karena ….
A. halogen sangat stabil
B. halogen sangat reaktif
C. senyawa halogen tidak stabil
D. senyawa halogen sukar terurai
E. halogen terdapat sebagai molekul diatomik
A. halogen sangat stabil
B. halogen sangat reaktif
C. senyawa halogen tidak stabil
D. senyawa halogen sukar terurai
E. halogen terdapat sebagai molekul diatomik
15. Sifat-sifat unsur golongan alkali berubah sesuai perubahan nomor atom dari Li sampai Cs sebagai berikut, kecuali ….
A. jari-jari atom makin besar
B. energi ionisasi makin kecil
C. massa atom makin besar
D. densitas makin besar
E. titik leleh makin tinggi
A. jari-jari atom makin besar
B. energi ionisasi makin kecil
C. massa atom makin besar
D. densitas makin besar
E. titik leleh makin tinggi











Tidak ada komentar:
Posting Komentar